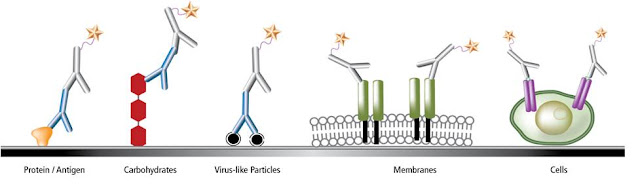
超靈敏電化學發光免疫分析技術 Electrochemiluminescence (ECL)_Immunogenicity
免疫原性 (Immunogenicity
of Therapeutic Protein Product)
何謂免疫原性?
這裡指的是根據美國食品藥物管理局(FDA)於2014年8月所頒布之治療型蛋白質藥物產品免疫原性評估指引(Guidancefor Industry: Immunogenicity Assessment for Therapeutic Protein Products)所定義之治療型蛋白質藥物活性成分或其所含相關蛋白質引發的不良免疫反應,包括: 過敏反應(anaphylaxis)、細胞激素釋放症狀(cytokine release
syndrome)、原生性蛋白質交叉中和反應(cross-reactive
neutralization of endogenous protein mediating critical functions)…等,均會影響病人的用藥安全及藥品療效,所以蛋白質藥物在上市前的研發過程中,除了對特定疾病的療效外,也不須同時評估免疫原性的影響,以降低蛋白質藥物使用上的風險。因此,除了美國食品藥物管理局外,世界衛生組織(WHO)、歐洲藥物管理局(EMA)也皆有相關指引及規範。
1.
抗治療型蛋白質藥物抗體(Anti-drug
antibody;ADA)偵測篩選
2.
抗治療型蛋白質藥物抗體驗證(Confirmatory
ADA assay)
3.
特性分析 (Characterization
assay)
4.
中和性抗治療型蛋白質藥物抗體鑑定(Neutralizing
antibody assay)
簡而言之,免疫原性評估即針對治療型蛋白質藥物因免疫反應產生的抗治療型蛋白質藥物抗體(ADA)進行偵測、驗證、特性分析及鑑定;所產生的抗治療型蛋白質藥物抗體中,又以會中和治療型蛋白質藥物功能的中和性抗治療型蛋白質藥物抗體最為關鍵。
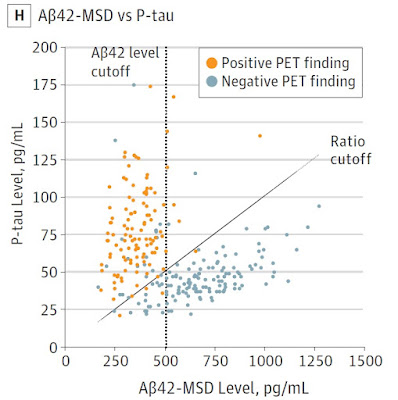
目前免疫原性評估方法學中,有幾個嚴峻的挑戰,如: 抗治療型蛋白質藥物抗體偵測靈敏度、基質效應及血藥兼容性(Drug
tolerance);以偵測靈敏度來說,美國食品藥物管理局在2014的評估指引中建議靈敏度至少需達250 – 500 ng/ml,在2016年更建議修正至100 ng/ml的範圍,隨著技術的日新月異,偵測靈敏度的偵測門檻只會越來越低;一個治療型蛋白質藥物的研發通常需要5 – 10年的時間,所以用一個符合現在,甚至未來需求的評估分析平台,對各藥廠或研發單位實為重要;MSD超靈敏電化學發光免疫分析技術對抗治療型蛋白質藥物抗體的靈敏度可達10 ng/ml,符合對免疫原性評估的未來要求。除此之外,MSD超靈敏電化學發光免疫分析技術也有低基質性應與高血藥兼容性的優點,所以目前各大藥廠、研發單位或CRO公司皆以MSD超靈敏電化學發光免疫分析技術為免疫原性評估方法的首選。
Bridging Immunogenicity Assay on MSD Streptavidin/High Bind Avidin Gold Plate
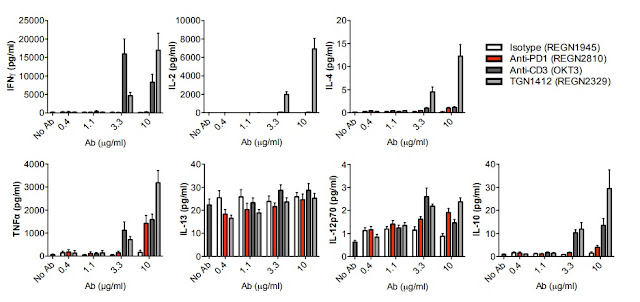
應用案例: 美國FDA首個PD-1腫瘤治療藥物-美商默沙東的Keytruda(Pembrolizumab)
Bridging Immunogenicity Assay on MSD Streptavidin/High Bind Avidin Gold Plate
應用案例: 美國FDA首個PD-1腫瘤治療藥物-美商默沙東的Keytruda(Pembrolizumab)






留言
張貼留言