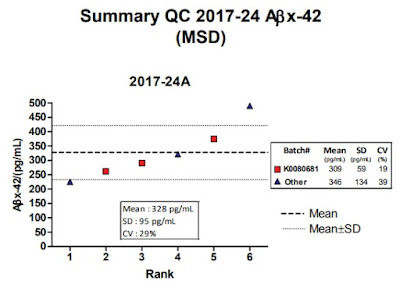
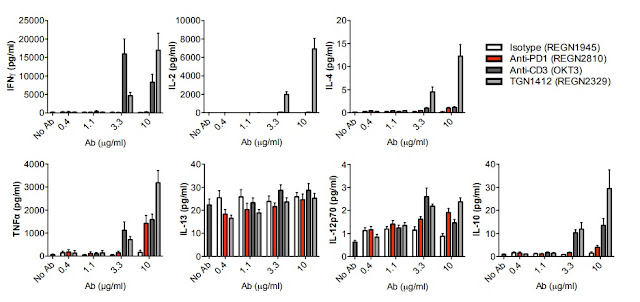
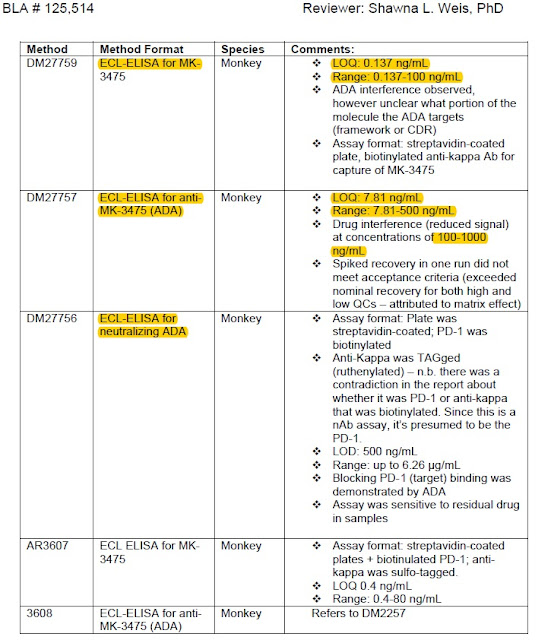
免疫原性重要嗎? 用一個故事告訴您! 2016年三月Pfizer藥廠於免疫風濕疾病專門期刊A nnals of the Rheumatic Diseases投稿一篇名為 Comparing the immunogenicity of the etanercept biosimilar SB4 with the innovator etanercept: another consideration的文章,文中討論Samsung Bioepis藥廠所生產的蛋白質藥SB4 (Pfizer治療類風濕關節炎用藥etanercept的生物相似藥)第三期臨床結果之可議性; Samsung Bioepis藥廠在第三期臨床結果報告中指出SB4的免疫原性比原用藥 etanercept低(在用藥第24週後,使用SB4產生抗藥性抗體的病人比例有0.7%;使用 etanercept 產生抗藥性抗體的病人比例有13.1%),暗示SB4在用藥安全上是乎比 原用藥 etanercept安全;所以, Pfizer在其 投稿的文章中直接指出 Samsung Bioepis藥廠所作的 免疫原性評估方法可能因較低的藥物兼容性而導致偵測方法靈敏度不足而無法偵測到抗藥抗體,所以懷疑其結果。然而, Samsung Bioepis藥廠也於同年五月在相同期刊回覆一篇 文章明確針對 Pfizer藥廠的懷疑 說明,文中清楚明白的指出 Samsung Bioepis藥廠臨床三期 免疫原性評估方法 所使用的分析平台是目前各大藥廠普遍使用的MSD 超靈敏電化學發光免疫分析技術,沒有任何可議之處,其結果值得信任,直接反擊 Pfizer藥廠為自己說明 。 目前生物相似藥正進入百家爭鳴的時代,既然療效相似,剩下的就是比價格、開發時間與安全性, MSD 超靈敏電化學發光免疫分析技術是目前各大藥廠及CRO公司所使用的技術平台,可以提供一個大家都認可的實驗結果與時效性,提供生物相似藥臨床實驗完整的應用。 資料來源 : 1. Marshall L , Hickling T , Bill D , et al Comparing the immunogenicity of the etanercept biosimilar SB4 with the innovator eta